NIK zwraca także uwagę na problem oszukańczych praktyk, jakie stosują producenci i dystrybutorzy, którzy - kreując popyt - reklamują nierzadko suplementy jako równoważne produktom leczniczym. NIK wskazuje, że dzieje się to przy biernej postawie organów państwa i ostrzega, że taki stan może rodzić zagrożenie dla zdrowia, a nawet życia konsumentów.
W obecnym stanie prawnym każdy może wprowadzić suplement na rynek, deklarując jedynie jego skład organom sanitarnym w drodze tzw. notyfikacji. Teoretycznie istnieją szanse, że produkt, który trafia na rynek zostanie zbadany, jednak w praktyce skala rynku przekracza aktualne możliwości kontrolne Inspekcji Sanitarnej. Kontrole, które prowadzi Inspekcja dotyczą zaledwie części rynku, a same postępowania mogą trwać nierzadko - jak wykazała kontrola NIK - nawet kilka lat. W licznych przypadkach sprzedawane suplementy diety nie są badane. Ochrona konsumentów staje się wówczas fikcją.
Rynek suplementów diety rozwija się w Polsce bardzo dynamicznie. W 2015 r. Polacy wydali na suplementy diety 3,5 mld zł, kupując blisko 190 mln opakowań. Statystyczny Polak więc nabył sześć opakowań suplementów diety, wydając na nie ok. 100 zł. W rejestrze Głównego Inspektoratu Sanitarnego od 2007 r. wpisano łącznie blisko 30 tys. produktów zgłoszonych jako suplementy diety. Badania wykazują, że rynek ten w latach 2017-2020 będzie rozwijał się w tempie ok. 8 proc. rocznie.
Źródło danych: Raport PMR Rynek suplementów diety w Polsce w 2015 r.W świetle obowiązującego prawa suplement diety nie jest produktem leczniczym. Jest to żywność, która w ustawie o bezpieczeństwie żywności i żywienia zdefiniowana jest jako środek spożywczy, którego celem powinno być uzupełnienie normalnej diety. Występuje w postaci tabletek, kapsułek, saszetek, czyli ma formę i postać taką jak leki. W zestawieniu z nieuczciwą, bo wprowadzającą w błąd reklamą, może u osób nieznających bliżej cech tego produktu powodować mylne wyobrażenie o jego właściwościach leczniczych.
Suplement diety nie leczy. Suplement diety może uzupełnić niezbilansowaną dietę.
Skala problemu
Polski rynek suplementów diety rozwija się bardzo szybko. W rejestrze GIS od 2007 r. wpisano łącznie blisko 30 tys. produktów zgłoszonych jako suplementy diety. O ile w latach 2013-2015 przybywało ich 3-4 tys. rocznie, o tyle w 2016 r. już 7,4 tys. Dane Komisji Europejskiej wskazywały, że już w latach 1997-2005 polski rynek suplementów wzrósł o 219% i był to najwyższy wzrost wśród wszystkich państw Unii Europejskiej. W latach 2017-2021 wzrost może wynosić nawet ok. 8 procent rocznie (wg prognoz firmy PMR).
Dane uzyskane podczas kontroli wskazują, że na tle rozmiarów podaży i spożycia możliwość prawdziwie skutecznej kontroli rynku suplementów przez organy Inspekcji Sanitarnej po prostu praktycznie nie istnieje. W 2016 r., po odliczeniu dni wolnych od pracy, dziennie do weryfikacji przybywało przeciętnie ok. 30 powiadomień o produktach nowo wprowadzanych do obrotu. Tymczasem w Głównym Inspektoracie Sanitarnym przyjmowaniem i rozpatrywaniem powiadomień zajmowało się tylko siedem osób, wypełniających także inne zadania. NIK wskazuje, że polski rynek narażony jest szczególnie na nieuczciwe praktyki rynkowe, naruszające zbiorowe interesy konsumentów. W krajach o utrwalonych praktykach rynkowych nadużyciom zapobiega zjawisko samoograniczania się producentów i importerów w zakresie nieuczciwych praktyk. W Polsce propozycje takiego samoograniczania ze strony producentów pojawiły się dopiero w toku kontroli NIK.
Na dynamiczny rozwój rynku suplementów diety niewątpliwy wpływ ma ich reklama. Z danych Krajowej Rady Radiofonii i Telewizji wynika, iż od 1997 r. do 2015 r. liczba reklam z sektora produktów zdrowotnych i leków (w tym suplementów diety) wzrosła blisko dwudziestokrotnie, podczas gdy ogólna liczba reklam tylko trzykrotnie.

Polacy tymczasem niewiele wiedzą o suplementach diety. Przeprowadzone przez TNS Polska w 2014 r. badanie wykazało, że wiele osób mylnie uznało suplementy za „witaminy” (31 proc.), czy „minerały” (8 proc.), a aż 41 proc. badanych przypisało suplementom diety właściwości lecznicze, których produkty te nie mają. Ponadto 50 proc. pytanych uważało, że suplementy są tak samo kontrolowane jak leki.
Ustalenia kontroli wskazują, że w Polsce nie jest zapewniony właściwy poziom bezpieczeństwa suplementów diety. Organy państwowe odpowiedzialne za bezpieczeństwo stosowania tych produktów nierzetelnie realizowały zadania związane z wprowadzaniem ich po raz pierwszy do obrotu. Nieskuteczny był także nadzór nad jakością zdrowotną suplementów diety, również w niedostatecznym zakresie prowadzono edukację żywieniową dotyczącą tych produktów. Związane jest to przede wszystkim z nieadekwatnymi z punktu widzenia zapewnienia bezpieczeństwa suplementów diety rozwiązaniami legislacyjnymi, szczególnie w zakresie wprowadzania suplementów diety do obrotu po raz pierwszy oraz w zakresie reklamy tych produktów.
Notyfikacja suplementów diety
Wprowadzenie na rynek suplementu diety wymaga ze strony przedsiębiorcy jedynie prawidłowego złożenia powiadomienia do organu nadzoru, którym jest Główny Inspektor Sanitarny. Spełnienie tego warunku formalnego umożliwia sprzedaż zgłoszonego produktu.
Obowiązujący system notyfikacji pozwala bowiem wprowadzić do obrotu suplement diety natychmiast po złożeniu powiadomienia. Procedura weryfikacji powiadomienia ani ewentualne wszczęcie postępowania wyjaśniającego nie wstrzymują jego dystrybucji. W czasie trwających postępowań niezweryfikowany produkt - a jak wykazano w toku kontroli, niejednokrotnie zawierający niedozwolone, szkodliwe dla zdrowia składniki - może znajdować się w sprzedaży. Stan taki stwarza zatem możliwość wystąpienia zagrożenia dla zdrowia, a nawet życia konsumenta.
Dla rozpatrywanych powiadomień od przekazania ich do GIS przez podmiot wprowadzający, do chwili rozpoczęcia weryfikacji upływało średnio niemal 8 miesięcy (a maksymalnie blisko 1,5 roku). Wobec połowy ogólnej liczby powiadomień z lat 2014-2016, tj. ok. 6 tysięcy w ogóle nie rozpoczęto procesu weryfikacji, co oznacza, że nie podjęto nawet próby ustalenia, czy wprowadzane produkty są bezpieczne dla konsumentów. Nie oznacza to przy tym, że w odniesieniu do tych produktów, co do których rozpoczęto proces weryfikacji, podejmowane działania zapewniały konsumentom bezpieczeństwo. Wpływał na to niewiarygodnie długi czas realizacji procedur.
Średni czas trwania weryfikacji powiadomień wynosił 455 dni (maksymalnie 817 dni). Postępowania wyjaśniające wszczęte we wcześniejszym okresie, tj. w latach 2009-2010 trwały blisko 2.300 dni (ponad 6 lat), przy czym najdłuższe z tych postępowań - ponad 3.100 dni (ok. 8,5 roku).
Niestety, tuż obok legalnego rynku notyfikowanych suplementów diety tkwi tzw. szara strefa, czyli preparaty niedopuszczone do obrotu w Polsce, o co najmniej wątpliwej skuteczności. Na problem ten zwrócili uwagę eksperci, biorący udział w zorganizowanym przez NIK przed planowaną kontrolą Panelu ekspertów dotyczącym rynku suplementów diety. Za pilną kwestię uczestnicy Panelu uznali proceder podrabiania suplementów. Zyskowny rynek powoduje, że oryginalne produkty zaczynają być coraz częściej zastępowane przez fałszywki. To groźne zjawisko, bo nikt nie wie, co mogą zawierać tak wytworzone preparaty. Co gorsze, rynek ten jest w chwili obecnej nie do oszacowania ani przez instytucje publiczne, ani przez firmy zajmujące się badanami rynku, a biorąc pod uwagę ogólne zainteresowanie konsumentów suplementami diety, produkty te mogą cieszyć się dużą popularnością.
Bezpieczeństwo suplementów diety
Uznając, że suplementy diety nie stanowią zagrożenia dla zdrowia i życia, jeżeli są stosowane zgodnie z zaleceniem zamieszczonym na opakowaniu, organy Inspekcji Sanitarnej nie wykonywały w ogóle kompleksowych badań prób suplementów pod kątem zgodności faktycznego składu suplementu ze składem umieszczonym na opakowaniu.
W toku kontroli Najwyższa Izba Kontroli zleciła badanie losowo wybranych suplementów diety Narodowemu Instytutowi Leków (w kierunku badań jakościowych - określenia grupy drobnoustrojów i badań ilościowych - określenia liczby komórek drobnoustrojów w próbkach suplementów diety z grupy probiotyków) oraz Łódzkiemu Regionalnemu Parkowi Naukowo-Technologicznemu (przeprowadzenie analizy jakościowej pojedynczych związków z mieszaniny wieloskładnikowej wybranych próbek suplementów diety).
Na jedenaście badanych prób, w czterech próbkach suplementów diety z grupy probiotyków stwierdzono obecność niewykazanych w składzie szczepów drobnoustrojów. Również w czterech próbkach poddanych badaniu stwierdzono niższą, niż deklarowana na opakowaniu, liczbę bakterii probiotycznych. Co więcej, w jednej próbce wykryto zanieczyszczenie produktu - obecność bakterii chorobotwórczych z grupy Enterococcus Faecium, czyli tzw. bakterii kałowych. Ich obecność stwarzała poważne zagrożenie dla zdrowia, a nawet życia konsumentów. W związku z tą sprawą NIK poinformowała Głównego Inspektora Sanitarnego o stwierdzeniu bezpośredniego zagrożenia zdrowia i życia konsumentów, celem podjęcia działań zmierzających do wycofania skażonej partii produktu. Do dnia 3 lutego 2017 r. z wprowadzonej do obrotu partii tego suplementu w ilości 165 327 opakowań (ponad 1,65 miliona kapsułek) wycofano z obrotu jedynie 16 317 sztuk opakowań (163 tysiące kapsułek), ponieważ pozostała część tego suplementu została sprzedana przed wynikami kontroli NIK. W wyniku zawiadomienia skierowanego przez Prezesa NIK do Prokuratora Generalnego, prokuratura wszczęła postępowanie w zakresie czynu polegającego na wprowadzeniu do obrotu zafałszowanego suplementu diety, szkodliwego dla zdrowia lub życia człowieka. Podkreślić należy, że nawet przy tak niewielkiej skali badań zleconych przez Najwyższą Izbę Kontroli, odsetek produktów zawierających niekorzystne dla zdrowia składniki jest bardzo wysoki.
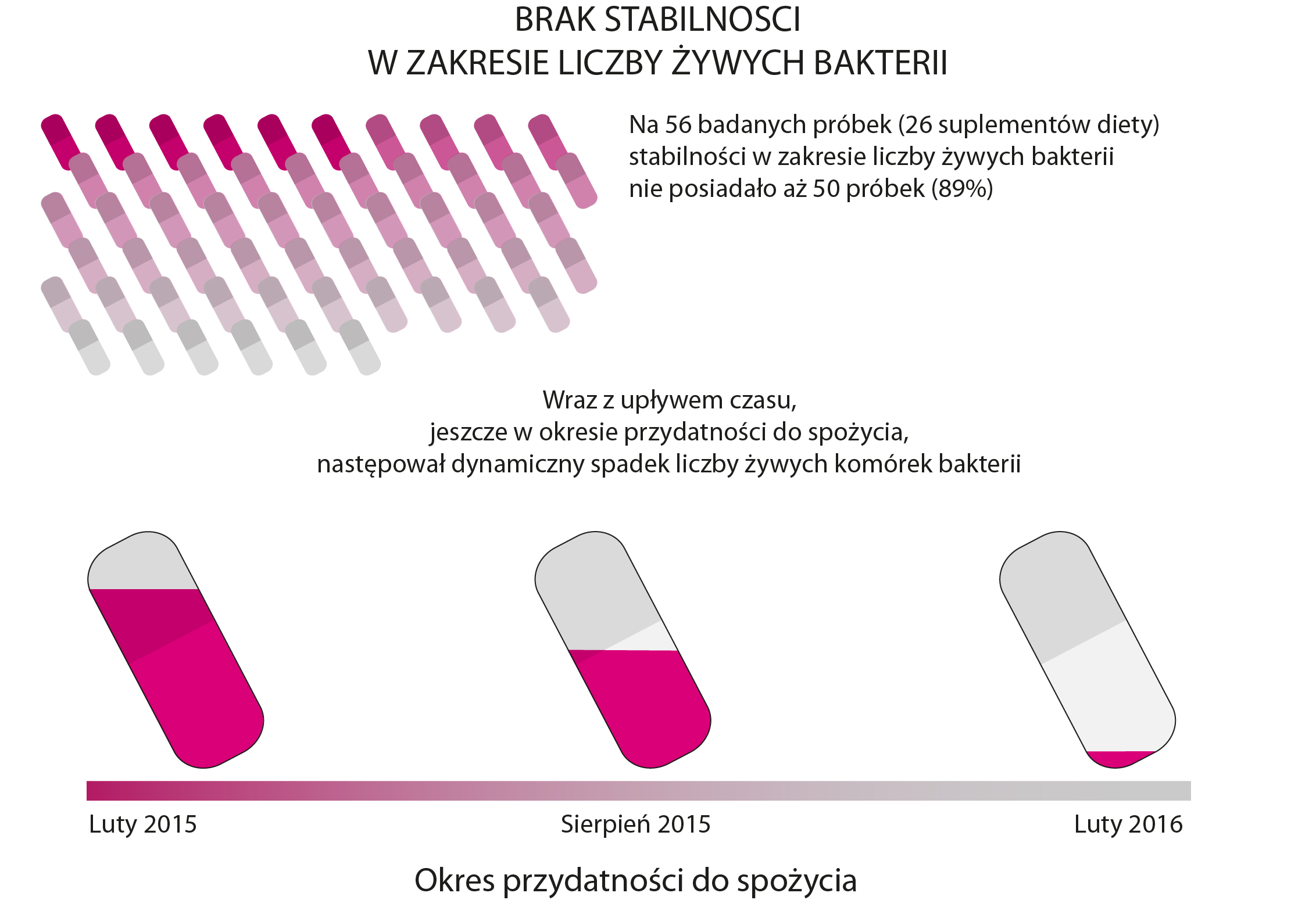
Narodowy Instytut Leków w ramach swoich statutowych badań oceniał zawartość żywych bakterii probiotycznych w suplementach w różnych okresach określonej przez producenta przydatności do spożycia, tj. od chwili wyprodukowania suplementu diety do końca okresu przydatności do spożycia badanego produktu.
Na 56 badanych próbek - stabilności liczby żywych bakterii nie posiadało aż 50 próbek (89 proc.). Wraz z upływem czasu, jeszcze w okresie przydatności do spożycia, następował dynamiczny spadek liczby żywych komórek bakterii. Zdarzało się, że liczba żywych, korzystnych dla zdrowia bakterii w części próbek spadła miliardkrotnie. Np. w jednym z suplementów ważnym do lutego 2016 r., z deklarowanej liczby bakterii 2,5x109, w lutym 2015 r. było 2,3x107, w sierpniu 2015 r. - jedynie 2,3x101, a w lutym 2016 r. - mniej niż 101. Wśród badanych suplementów diety były też i takie, które z deklarowanej liczby 2x109 czy 4x108 bakterii na rok przed upływem terminu ważności posiadały mniej niż 10 bakterii. Ponadto jeden z probiotycznych suplementów diety zakażony był grzybami.
Jako nieskuteczny oceniono nadzór Głównego Inspektora Sanitarnego nad podległymi organami Inspekcji Sanitarnej odpowiedzialnymi za każdorazowe i natychmiastowe eliminowanie z obrotu niebezpiecznych produktów.
Z wybranych do kontroli 45 suplementów diety, które nie powinny być wprowadzone do obrotu z uwagi na zawartość niedozwolonych składników, aż 38 w czasie prowadzenia badań kontrolnych przez NIK znajdowało się w sprzedaży (sprawdzono sprzedaż internetową). Produkty te zawierały składniki kwestionowane przez Głównego Inspektora Sanitarnego, stwarzające niebezpieczeństwo dla konsumentów, gdyż - jak wskazywał Inspektor w pismach kierowanych do podmiotów wprowadzających te produkty do obrotu - mogły m.in. wykazywać właściwości alergenne i rakotwórcze, powodować zakażenia dróg oddechowych i moczowych, zapalenie opon mózgowo-rdzeniowych, przyczyniać się do powstawania ropni, zapalenia wsierdzia, osierdzia, czasami zatruć pokarmowych.
W związku z ustaleniami, jeszcze w toku kontroli Najwyższa Izba Kontroli poinformowała Głównego Inspektora Sanitarnego o stwierdzeniu bezpośredniego niebezpieczeństwa dla zdrowia lub życia ludzkiego.
Główny Inspektor nie podjął jednak wystarczających działań w celu wyeliminowania zagrożeń. Według stanu na 3 lutego 2017 r. 33 z kwestionowanych 38 suplementów diety nadal znajdowało się w sprzedaży internetowej i zawierało szkodliwe substancje. Zgodnie bowiem z opinią powołanego w trakcie kontroli NIK biegłego - kwestionowany składnik 5-htp „jako prekursor serotoniny może wchodzić w interakcje z lekami w tym np. ze środkami stosowanymi w terapii migreny, stosowanymi w leczeniu zaburzeń/chorób psychicznych, a zwłaszcza inhibitorami wychwytu serotoniny. Ponadto spożywanie 5-htp może powodować drażliwość, irytację, objawy przypominające objawy maniakalne a także (chociaż rzadziej) depresję.” Biegły wskazał, że spożycie obecnych w kwestionowanych suplementach azotanów w ilości powyżej akceptowanego dziennego spożycia prowadzi do wzrostu azotanów zarówno w żołądku jak i w krążeniu, które wchodzą w reakcje z białkami, w tym także z kreatyną i powstaje wówczas N-nitrososarcosine (NSAR), która jest substancją rakotwórczą. W stosunku do siarczanu agmatyny obecnego w suplementach diety nie ma danych historycznych potwierdzających, że spożycie tej substancji nie stanowi zagrożenia dla zdrowia człowieka, co oznacza, że nie może być obecna na rynku europejskim.
W innym przypadku na otrzymane (w grudniu 2015 r.) wyniki badań laboratoryjnych suplementu diety z grupy tzw. „spalaczy tłuszczu”, wskazujące na zafałszowanie produktu stymulantami, podobnymi strukturalnie do amfetaminy, Główny Inspektor zareagował dopiero po ok. czterech miesiącach. Podjęte (już w trakcie kontroli NIK) działania spowodowały wycofanie z rynku jedynie 316 opakowań tego produktu, podczas gdy łącznie od 2012 r. tylko jeden importer rozdystrybuował ponad 10 tys. opakowań (tj. ponad 900 tys. tabletek) tego suplementu. NIK podkreśla szczególną wagę sytuacji, ponieważ ten konkretny suplement obok niezadeklarowanej substancji zawierał także składniki, które nie powinny wchodzić w skład środków spożywczych, gdyż są niebezpieczne dla ludzi (m.in. Acacia Rigidula, należącą do roślin, które zawierają DMT (dimetylotryptaminę), środek wymieniony w ustawie o przeciwdziałaniu narkomanii, jako substancja psychoaktywna grupy I-P).
W trakcie przygotowywania kontroli NIK doszło do jednostkowego, ale symptomatycznego dla funkcjonowania rynku zdarzenia. W marcu 2016 r. na jednej ze stron internetowych oferujących suplementy diety w kategorii „Moda i zdrowie/Medycyna”, dostępne było ogłoszenie oferujące substancję, zwaną potocznie pigułką gwałtu. Najwyższa Izba Kontroli poinformowała o tym fakcie Policję, która ustaliła m.in., że adres e-mail, z którego zamieszczono ogłoszenie należy do serwisu zajmującego się anonimizacją danych, uniemożliwiającą identyfikację właściciela skrzynki pocztowej, zaś właścicielem serwisu jest operator z Izraela. Operator ten poinformował Policję, że nie ma możliwości ustalenia konkretnych danych, gdyż nie przechowuje logowań swoich klientów. Ogłoszenie to jest dostępne w sieci internetowej od grudnia 2015 r. i cyklicznie „odświeżane”. Ostatnio dodano informację, że pigułka gwałtu jest po kilkunastu godzinach całkowicie usuwana z organizmu, a więc nie można wykryć i udowodnić jej podania. Po skierowaniu przez Prezesa Najwyższej Izby Kontroli zawiadomienia do Prokuratora Generalnego o stwierdzeniu faktów wskazujących na uzasadnione podejrzenie popełnienia czynu polegającego na sprzedaży w internecie tzw. pigułki gwałtu wszczęte zostało postępowanie karne w tej sprawie.
W Głównym Inspektoracie Sanitarnym nie monitorowano interakcji i działań niepożądanych stosowania suplementów diety. Zadanie to przypisane zostało Zespołowi do spraw Suplementów Diety - organowi opiniodawczo-doradczemu Głównego Inspektora Sanitarnego działającemu w ramach Rady Sanitarno-Epidemiologicznej. Organ ten jednak nie realizował tego zadania, a także dwóch innych, kluczowych dla bezpieczeństwa suplementów diety zadań. Tymczasem z opinii biegłego wynika, iż nieodpowiedzialne stosowanie suplementów diety może stanowić zagrożenie wynikające m.in. z niebezpieczeństwa przedawkowania, niepożądanych interakcji między składnikami suplementów a składnikami leków, wpływu stosowania suplementów na wyniki badań diagnostycznych itd. Z opinii ekspertów pozyskanych w toku kontroli NIK wynika m.in., że nadmierne spożywanie witamin i składników mineralnych zawartych w suplementach diety może powodować negatywne skutki, gdy ich stosowanie nie ma uzasadnienia z żywieniowego punktu widzenia.
Zaciera się granica pomiędzy koniecznością zażywania suplementów diety a stosowaniem ich bez uzasadnienia. Istotne jest, iż suplementy diety powinny być stosowane w celu zmniejszenia ryzyka niedoboru składników odżywczych w organizmie człowieka, kiedy niemożliwe jest zapewnienie diety pokrywającej wszystkie potrzeby żywieniowe. Jednak uzupełnienie diety winno być poprzedzone analizą określającą nawyki żywieniowe, stan ogólny człowieka, przeciwwskazania zdrowotne, choroby przebyte, występujące choroby przewlekłe, stosowane leki, terapie itp., a nie bezmyślną reklamą i złudnymi obietnicami.
Np. przedawkowanie witaminy A może mieć działanie teratogenne, nadmiar miedzi może powodować uszkodzenia wątroby, wysokie dawki fluoru - fluorozę, nadmiar żelaza - hemochromatozę. Osobom w trakcie kuracji antynowotworowej podanie przetworów zielonej herbaty zaburza leczenie przeciwnowotworowe. U osób chorych na epilepsję przyjmowanie preparatów z Ginkgo biloba powoduje redukcje skuteczności leków przeciwpadaczkowych. Pacjenci leczeni przeciwkrzepliwie warfaryną nie powinni stosować suplementów diety z zieloną herbatą, czy żeń-szeniem, które obniżają skuteczność przeciwkrzepliwą leku.
Również Minister Zdrowia nierzetelnie wypełniał obowiązki związane z nadzorem nad przestrzeganiem przepisów prawa żywnościowego w odniesieniu do suplementów diety. Organ ten nie dokonywał oceny ryzyka, nie analizował prawdopodobieństwa wystąpienia zdarzeń niepożądanych, niebezpiecznych lub wyrządzających szkodę.
W Ministerstwie Zdrowia nie zapewniono warunków organizacyjno-finansowych do realizacji przez Radę do Spraw Monitoringu Żywności i Żywienia zadań związanych z funkcjonowaniem programu monitoringu na potrzeby oceny ryzyka. Co najmniej od 2011 r. Rada nie realizowała przypisanych jej zadań, a Minister Zdrowia nie egzekwował od niej przygotowywania stosownych opracowań, przyjmując bierną postawę w tym zakresie i uznając, że brak aktywności Rady nie miał wpływu na efektywność prowadzenia monitoringów w zakresie bezpieczeństwa żywności i żywienia. W ten sposób przewidziany w ustawie o bezpieczeństwie żywności i żywienia organ opiniodawczy stał się organem fasadowym, niewpływającym w żadnym stopniu na zapewnienie bezpieczeństwa konsumentom suplementów diety. Co więcej, mimo że mamy do czynienia z organem ustawowym, to trudno w chwili obecnej ustalić, czy organ ten w ogóle istnieje.
Nadzór nad reklamą suplementów diety
Prezes Urzędu Ochrony Konkurencji i Konsumentów oraz organy Inspekcji Sanitarnej w ograniczonym i niedostatecznym zakresie sprawowali nadzór nad reklamą suplementów diety. Minister Zdrowia zaś w ogóle nie podejmował działań w tym zakresie.
Wszczęte przez Prezesa UOKiK w odniesieniu do reklam suplementów diety postępowania stanowiły jedynie 0,6 proc. wszystkich prowadzonych w okresie objętym kontrolą postępowań. W znakomitej większości przypadków Prezes UOKiK stosował praktykę kierowania otrzymywanych zawiadomień o podejrzeniu naruszenia zbiorowych interesów konsumentów odnoszących się do reklamy suplementów diety, do innych organów administracji.
Główny Inspektor Sanitarny nie monitorował reklam suplementów diety w mediach, a organy Inspekcji Sanitarnej szczebla wojewódzkiego i powiatowego tylko sporadycznie kontrolowały internetowy rynek tych produktów.
Tymczasem, z dokonanego w trakcie kontroli NIK przeglądu stron internetowych, na których prezentowane były suplementy diety wynikało, że reklamy poszczególnych produktów zawierają m.in. treści, które przypisują suplementom właściwości lecznicze, sugerują, że stanowią one niezbędny element codziennej diety, będący remedium na liczne dolegliwości i potrzeby; obiecują szybką poprawę zdrowia oraz wykorzystują niewiedzę, nieświadomość, brak doświadczenia klientów, nadużywają zaufania odbiorców.
W znacznej części nieuczciwą z punktu widzenia ochrony konsumentów formą promocji suplementów diety jest stosowanie przez producentów praktyki tzw. znaków parasolowych („umbrella branding”). Polega ona na upodabnianiu do siebie produktów należących do różnych kategorii: zwłaszcza dotyczy to przypadków, gdy pod określoną marką zostaje wypromowany na rynku środek leczniczy, a następnie - pod tą samą lub zbliżoną marką - zostaje wprowadzony na rynek suplement diety, który oczywiście właściwości leczniczych nie wykazuje.
Kolejnym problemem jest oznaczanie opakowań suplementów diety. Suplementy diety są wprowadzane do obrotu, prezentowane i reklamowane pod nazwą "suplement diety", która nie może być zastąpiona nazwą handlową tego środka spożywczego. Nazwa handlowa może natomiast być użyta jako oznakowanie dodatkowe - wówczas określenie "suplement diety" powinno być zamieszczone w bezpośrednim sąsiedztwie tej nazwy. Jednak często zdarza się, iż określenie to - wprawdzie zamieszczone w bezpośrednim sąsiedztwie nazwy handlowej - prezentowane jest czcionką znacznie mniejszą, niejednokrotnie „rozmytą”, mało widoczną. Dotyczy to również prezentacji suplementów w reklamach telewizyjnych.
Z reguły opakowania wyglądają dziś tak

Tak byłoby czytelniej i bezpieczniej

Wnioski i uwagi NIK
Rynek suplementów diety w Polsce ocenić należy jako obszar wysokiego ryzyka zdrowotnego, niedostatecznie zdiagnozowanego i nadzorowanego przez służby państwowe odpowiedzialne za bezpieczeństwo żywnościowe. Najwyższa Izba Kontroli wskazała zatem na konieczność objęcia tego obszaru przez Ministra Zdrowia szczególnym nadzorem, w celu wyegzekwowania od organów sprawujących nadzór nad bezpieczeństwem suplementów diety realizacji wszystkich obowiązków wynikających z już obowiązujących aktów prawnych.
Ponadto, Najwyższa Izba Kontroli widzi potrzebę podjęcia działań legislacyjnych, zmierzających do wprowadzenia nowych kompleksowych rozwiązań prawnych rangi ustawowej, dotyczących suplementów diety.
W ocenie NIK konieczne jest także podjęcie przez Ministra Zdrowia na szeroką skalę działań o charakterze edukacyjno-informacyjnym w zakresie racjonalnego stosowania suplementów diety. Działania te powinny być przeprowadzane we współpracy z Ministrem Edukacji Narodowej oraz Ministrem Nauki i Szkolnictwa Wyższego, aby informacje na temat suplementacji i zagrożeń związanych z nieodpowiedzialnym spożywaniem suplementów diety przekazywać obywatelom już w młodym wieku, na równi z wiedzą dotyczącą niebezpieczeństwa stosowania różnego rodzaju używek.
W zakresie sprzedaży internetowej, niezbędne jest także podjęcie przez Głównego Inspektora Sanitarnego działań prawno-organizacyjnych umożliwiających dokonywanie przez Inspekcję Sanitarną zakupu suplementów diety w formie sprzedaży na odległość (sprzedaż internetowa), w celu pobrania próbek z zakupionego produktu do wykonania badań laboratoryjnych.
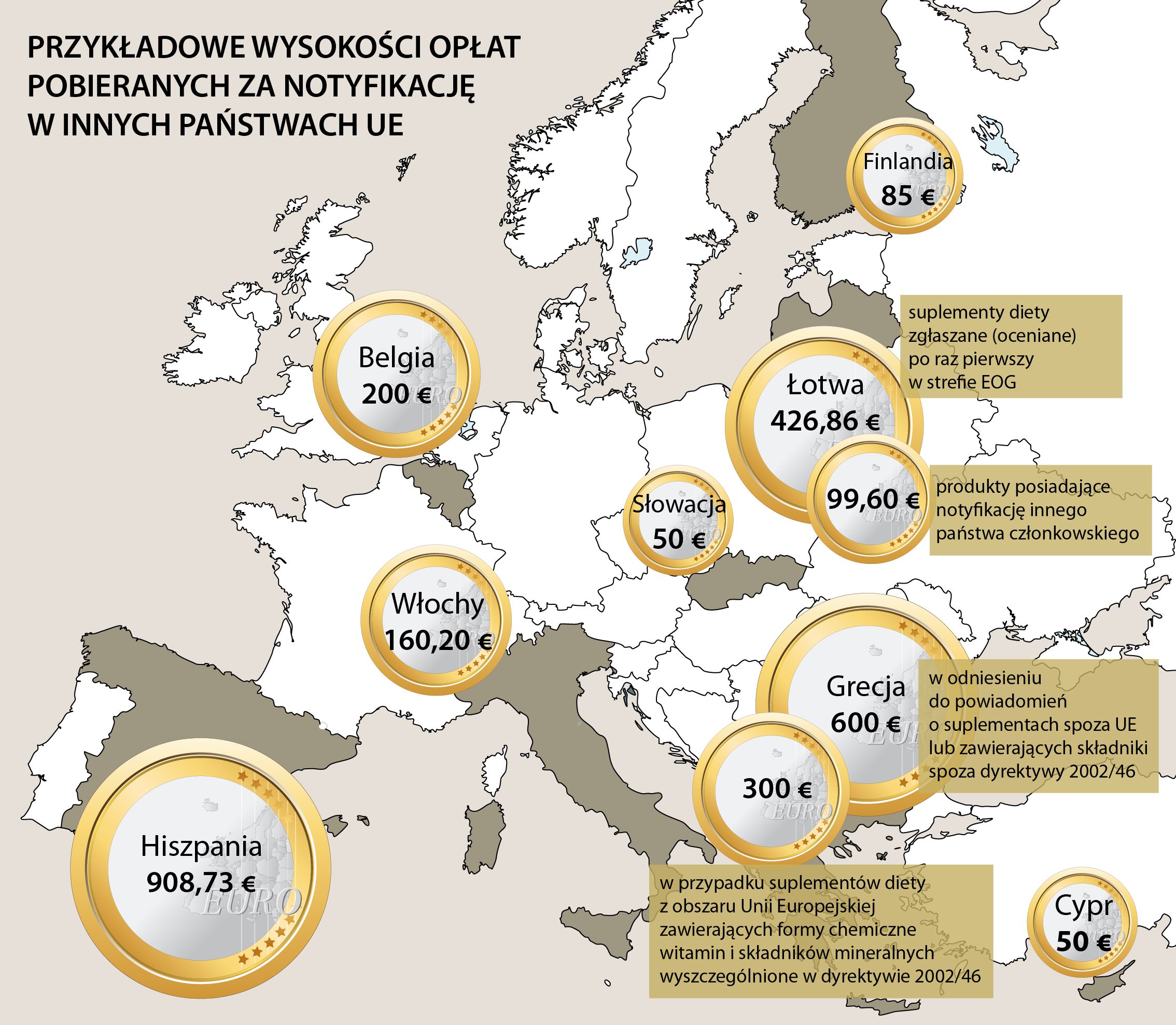
Brak opłat z tytułu notyfikacji suplementów diety sprawia, że do Inspekcji Sanitarnej zgłaszane są także produkty, które w rzeczywistości nie mają trafić na rynek, a ich zgłoszenie ma na celu jedynie „sondowanie opinii” GIS w odniesieniu do ich składu. Angażuje to siły i środki tego organu w rozważania dotyczące produktów nietrafiających na rynek. Ograniczeniu tego zjawiska sprzyjałoby wprowadzenie opłat z tego tytułu (w niektórych krajach UE obowiązują takie opłaty - na poziomie od kilkudziesięciu do kilkuset euro za zgłoszenie). Środki uzyskane z tych opłat mogłyby być kierowane na cele związane z edukacją społeczną w zakresie suplementów diety i promocje zdrowego trybu odżywiania.
Wnioski dotyczące zmiany prawa (wnioski de lege ferenda)
Najwyższa Izba Kontroli uznaje za zasadne zwrócenie się do Prezesa Rady Ministrów o podjęcie przez rząd inicjatywy ustawodawczej mającej m.in. na celu:
- wprowadzenie systemu opłat za notyfikację suplementów diety;
- wprowadzenie systemu ostrzegania konsumentów przed niezbadanymi suplementami diety znajdującymi się w obrocie, poprzez informowanie o fakcie nienotyfikowania danego suplementu diety;
- wydzielenie z rejestru GIS suplementów diety, wobec których podjęto działania weryfikujące z uwagi na wątpliwości, co do ich jakości (szczególnie bezpieczeństwa);
- uregulowanie procedur wycofywania z rynku przez producenta lub dystrybutora suplementów diety, bądź zaprzestania ich produkcji/dystrybucji i rezygnacji z wprowadzania do obrotu;
- ustalenie tzw. zerowego poziomu dla wybranych składników suplementów diety, gdy takie składniki, ze względu na ochronę życia lub zdrowia ludzkiego, uznane zostaną za niebezpieczne;
- podwyższenie kar pieniężnych dla podmiotów wprowadzających do obrotu niebezpieczne lub nielegalne suplementy diety do poziomu, by zgodnie z art. 17 ust. 2 unijnego rozporządzenia nr 178/2002 - były skuteczne, proporcjonalne i odstraszające.
Z kolei dla zapewnienia wysokiego poziomu ochrony konsumentów, istnieje potrzeba zwrócenia się do Ministra Zdrowia o podjęcie działań projektodawczych zmierzających do uszczegółowienia i dostosowania do dzisiejszych potrzeb regulacji prawnych w zakresie reklamy suplementów diety, w szczególności poprzez:
- podwyższenie wysokości kar pieniężnych, jakie mogą być nałożone przez organy Państwowej Inspekcji Sanitarnej na przedsiębiorcę za nieprzestrzeganie wymagań w zakresie znakowania środków spożywczych, w tym w zakresie prezentacji, reklamy i promocji;
- monitorowanie reklam suplementów diety przez Głównego Inspektora Sanitarnego i Prezesa UOKiK;
- wprowadzenie zakazu wskazywania na etykietach, w prezentacji i reklamie na właściwości zapobiegawcze, lecznicze lub uzdrawiające choroby ludzkie suplementów diety,
- wprowadzenie zakazu reklamy suplementów diety z wykorzystaniem wizerunku osób ze środowiska medycznego lub farmaceutycznego lub odwoływaniu się do osób sugerujących posiadanie wykształcenia medycznego lub farmaceutycznego lub odwoływaniu się do zaleceń takich osób. Zgodnie z Kodeksem Etyki Lekarskiej lekarzom nie wolno zalecać metod, które są bezwartościowe i niesprawdzone klinicznie oraz narażać pacjentów na niepotrzebne wydatki,
- uregulowanie stosowanej przez firmy praktyki „umbrella branding” (znaków parasolowych), która budzi wiele wątpliwości prawnych w przedmiocie dopuszczalnego zakresu upodabniania do siebie produktów należących do różnych kategorii (dualizm produktowy środków farmaceutycznych i suplementów diety).
Ponadto wydaje się niezbędne doprecyzowanie istniejącego już obowiązku umieszczania na opakowaniach informacji, że dany produkt jest suplementem diety, aby informacje te były odpowiednio czytelne, łatwo dostrzegalne dla każdego konsumenta, o rozmiarach czcionki umożliwiającej zapoznanie się z tą informacją różnym grupom konsumentów.
Przy formułowaniu powyższych wniosków de lege ferenda NIK uwzględniła opinię na temat możliwości zastosowania w prawie krajowym wskazanych w informacji o wynikach kontroli rozwiązań prawnych dotyczących wprowadzania do obrotu suplementów diety oraz ich reklamy, pod kątem zgodności z regulacjami Unii Europejskiej.
Przedmiotem ogólnopolskiej kontroli Najwyższej Izby Kontroli, koordynowanej przez Delegaturę NIK w Łodzi, były zagadnienia związane z działaniami organów państwa w obszarze wprowadzania do obrotu suplementów diety. Celem kontroli była przede wszystkim ocena, czy działania tych organów, podejmowane zgodnie z aktualnymi obowiązującymi przepisami prawa, są wystarczające dla zapewnienia bezpieczeństwa zdrowotnego konsumentów spożywających suplementy diety. Analizie poddano także stan obowiązującego w tym zakresie ustawodawstwa.